
В конце 80-х годов на остеобластах человека найдены рецепторы к эстрогенам [Э] [35], которые дали сведения о прямом воздействии половых гормонов на клетки костной ткани. Эстрогены подавляют формирование и активность остеокластов, а увеличивая апоптоз, уменьшают и продолжительность их жизни. Многие исследования подтверждают положительное влияние Э на образование, дифференцировку, пролиферацию и функциональную активность остеобластов [34]. Для нормального процесса ремоделирования необходимо наличие Э, их дефицит влияет на цикл костного ремоделирования следующим образом. Во-первых, повышается частота активации базисных многоклеточных единиц (БМЕ), что ведет к ускоренному метаболизму костной ткани. Во-вторых, удлиняется фаза резорбции вследствие уменьшения апоптоза остеокластов [31, 41, 42]. В результате вышеперечисленных изменений объем лакуны резорбции повышается настолько, что остеобласты не в состоянии заполнить ее.
В губчатой кости увеличение продолжительности жизни остеокластов ведет к увеличению глубины резорбции и перфорации трабекулярной пластины [38].
Изменения эндокринной функции яичников влияет на костное ремоделирование до начала менопаузы и являются причиной значительного снижения костной массы.
Хотя в эндокринной функции яичников происходят значительные изменения, они касаются не всех гормонов. Андрогены, особенно тестостерон, продуцируются яичниками в предменопаузном периоде, однако их секреция у некоторых женщин продолжается и после наступления менопаузы [3]. Уровень циркулирующего тестостерона снижается в течение предменопаузы на 25-50 %. У женщин в постменопаузе основным источником тестостерона является конвертация его из ДГАЭ-С19 [10]. Этот процесс происходит в жировой ткани, которая является принципиальным источником эстрогенов у женщин в постменопаузном периоде [5].
Таким образом, гормональный статус значительно отличается в постменопаузном периоде по сравнению с предменопаузным. Если недостаточная секреция эстрадиола яичниками оказывает доминирующее действие на МПК кости в ранний постменопауз период, то продукция других гормонов, особенно андрогенов, может иметь важное значение в поздний период жизни [4].
Одним из характерных признаков снижения костной массы сразу после развития яичниковой недостаточности является появление свободных трабекул, утративших связь с соседними трабекулами. Для того, чтобы объяснить их появление, необходимо оценить архитектурные нарушения, которые являются составной частью феномена снижения костной массы у женщин в постменопаузный период [2].
Эстрогены также влияют на гомеостаз кальция. Терапия эстрогенами значительно улучшает кишечную абсорбцию кальция. К тому же начало секреции ПТГ регулируется эстрогенами. Они улучшают синтез 1, 25- дигидроксивитамина-D почками.
Согласно исследованиям последних лет, чаще встречается постменопаузный остеопороз в силу резкого снижения концентрации эстрогенов. Секреция половых гормонов практически прекращается через 3-5 лет постменопаузного периода. Стартовая МПК и скорость потери костного вещества определяют риск развития остеопороза. Он является самой частой костной патологией скелета у женщин пожилого и старческого возраста. На зависимость костной ткани от половых гормонов указывают также следующие клинические факты: раннее закрытие зон трубчатых костей и остановка роста при преждевременном половом созревании; позднее закрытие зон трубчатых костей и высокий рост – при задержке полового созревания [1].
Число рецепторов к эстрадиолу в костной и хрящевой ткани очень велико, поэтому кость считают органом – мишенью для эстрадиола. До 50 лет колебания МПК и концентрации эстрадиола остаются в пределах нормы (на 12-й день МЦ составляет 218,4 ± 21,36 пг/мл,
Т-критерий в L2-L4 равен -1,0SD, в шейках бедренных костей – 0,2SD). Предменопаузные колебания эстрадиола отражаются на МПК, в первую очередь, в позвоночнике, Т-критерий -1,5SD. В процессе образования кости необходима нормальная концентрация эстрадиола, усиливающего биосинтез коллагеновых и неколлагеновых белков [9].
Эстрогеновые рецепторы в костной ткани
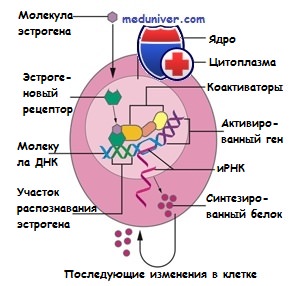
Структура эстрогенового рецептора (ЭР) (теперь известного как ЭРа) была описана в 1986 г.. Он состоит из 5 компонентов или доменов, которые поделены на 6 регионов, обозначаемых буквами A-F, вместо обычных 5 регионов, как у большинства стероидных рецепторов. Регион F представляет собой С-терминальный сегмент из 42 аминокислот, оказывающий влияние на конформационные изменения, происходящие после связывания с эстрогеном/антиэстрогеном. Таким образом, он модулирует уровень транскрипционной активности, вероятнее всего, за счет влияния на взаимодействие с корегуляторными протеинами.
Читайте также: Как шить ткань сеточку
Молекулярная масса эстрогенового рецептора (ЭР) составляет 66 000 Да, он состоит из 595 аминокислот. мРНК эстрогеновый рецептор (ЭР) содержит 6,8 килобазы (тысяч нуклеотидов) и состоит из 8 экзонов, производных гена, локализованного на длинном плече хромосомы 6. Совсем недавно была открыта еще одна форма ЭР, которая получила название ЭРb; она кодируется геном, расположенным на хромосоме 14, в непосредственной близости от генов, имеющих отношение к болезни Альцгеймера.
Эти формы эстрогенового рецептора высокогомологичны в ДНК-связывающих (97%) и лигандсвязывающих доменах (59%), но менее гомологичны в скрепляющем (30%), регуляторном (17%) и F-регионах (17,9%). Из этого следует, что характеристики связывания этих двух форм рецепторов сходны между собой, но они существенно различаются по способности активировать транскрипцию гена из-за различий в регуляторном домене TAF-1, который выражен минимально или вообще отсутствует у ЭРb.
Для нормального функционирования яичника необходимо наличие как эстрогеновый рецептор-а (ЭРа), так и эстрогеновый рецептор-b (ЭРb), что было продемонстрировано в экспериментах на мышах с «выключением» («нокаутом») рецепторов. ЭРа в основном обеспечивают эстрогенные эффекты в других тканях, в том числе в матке.
17b-эстрадиол связывается с эстрогеновым рецептором с гораздо большей аффинностью, чем эстрон или эстриол. Кроме того, связывание эстрадиола с рецептором и его последующая активация также усиливают «кооперативный эффект»; иными словами, связывание эстрадиола в одном участке повышает его аффинность к связыванию в другом участке, что позволяет рецепторам реагировать на малейшие изменения в концентрации гормона. Относительно длительное действие эстрадиола отчасти обусловлено высокоаффинным состоянием, достигаемым его рецепторами.
В то же время кломифен осуществляет свое антиэстрогенное действие за счет феномена «обратного кооперативного эффекта», предотвращая переход эстрогеновых рецепторов из низкоаффинного в высокоаффинное состояние.
Оба эстрогеновых рецептора (ЭРа и ЭРb) неодинаково экспрессируются в различных тканях, что обусловливает разную реакцию на один и тот же подтип гормона. ЭРа преимущественно экспрессируются в тканях рака молочной железы, строме яичника и эндометрия. ЭРb экспрессируются в не совсем обычных тканях-мишенях, в том числе в почках, слизистой оболочке кишечника, легких, костях, головном мозге, эндотелиальных клетках и предстательной железе. 17р-эстрадиол и эстрон обладают большим сродством к ЭРа и поэтому осуществляют свои эффекты преимущественно в тканях-мишенях, где экспрессируются ЭРа.
Напротив, фитоэстрогены, такие как генистеин и куместрол, связываются преимущественно с эстрогеновым рецептором-а (ЭРа), что предполагает осуществление их эффектов в тех тканях-мишенях, где они и экспрессируются.
Конформационные изменения лигандсвязывающего региона у эстрогенового рецептора-а (ЭРа) и эстрогенового рецептора-b (ЭРb) тоже различаются в зависимости от того, какой лиганд связался с рецептором. Изменение конформации — основной фактор, определяющий способность рецептора взаимодействовать с коактиваторами и корепрессорами. Например, связываясь с ЭРа, эстрадиол активирует транскрипцию, а связываясь с ЭРb, угнетает ее. И наоборот, ралоксифен и тамоксифен ингибируют транскрипцию при образовании комплекса с ЭРа и активируют ее при образовании комплекса с ЭРb.
Разная экспрессия адаптерных протеинов в тканях-мишенях и различная степень фосфорилирования также влияют на транскрипцию генов. Более высокая концентрация коактиваторов и корепрессоров в ткани-мишени может изменять ответ клеток этой ткани на воздействие одного и того же лиганда. Фосфорилирование рецептора протеинкиназами повышает транскрипционную активность этого рецептора: например, факторы роста, такие как ЭФР и ИФР-1, могут стимулировать протеин-киназное фосфорилирование, активируя эстрогеновый рецептор даже в отсутствие эстрогена.
Описаны соматические мутации эстрогенового рецептора-а (ЭРа), которые могут становиться причиной определенных заболеваний. Так, у пациента с пониженной минеральной плотностью костей, повышенной интенсивностью обновления костной ткани и неполным закрытием эпифизов длинных трубчатых костей была выявлена нонсенс-мутация (преждевременный стоп-кодон) гена ЭРа, что демонстрирует роль ЭРа в костном росте и гомеостазе. Мутации эстрогенового рецептора (ЭР) также были выявлены у пациенток с раком молочной железы. К таким мутациям относились делеция 5-го экзона в составе лигандсвязывающего домена, которая приводила к синтезу конститутивно-активного рецептора, и делеция 7-го экзона, обусловливающая доминантно-негативную активность и угнетение функции ЭР.
Эстрогеновые рецепторы в костной ткани
Профилактику остеопороза следует начинать в возрасте моложе 40 лет в связи со снижением максимальной костной массы. Еще более выраженная потеря костной ткани отмечается в постменопаузе, когда прекращается поддержка эстрогенами активности остеобластов. Женщинам следует предпринимать активные меры по защите костей от остеопороза посредством регулярных упражнений, приема кальцийсодержащих добавок (1500 мг элементарного кальция для женщин в постменопаузе) и витамина D (800 — 1200 ME в сутки).
Читайте также: Кухонный уголок поменять ткань
С началом постменопаузы рекомендуется определить исходную плотность костной ткани, а затем каждый год повторять данное исследование, пока не будут выявлены остеопения или остеопороз. Большинство препаратов, используемых для лечения остеопороза, до сих пор не утверждены для профилактики потери костной ткани. Для профилактических целей одобрены карбонат кальция, ралоксифен (Evista®), ризедронат натрия в таблетках (Actonel®) и препараты эстрогенов для ЗГТ.
Для того чтобы препарат был утвержден FDA для профилактики тех или иных состояний, польза от его применения должна превосходить возможные риски; требуется длительное рандомизированное клиническое исследование с включением большого числа здоровых женщин. ЗГТ эстрогенами традиционно считается основным методом предупреждения остеопороза в постменопаузе. К сожалению, ралоксифен характеризуется присущим всем эстрогенам риском тромбоэмболических осложнений, не имея при этом преимуществ в облегчении симптомов, характерных для постменопаузы.
Ралоксифен, действующий на эстрогеновые рецепторы аналогично тамоксифену, относится к лекарственным средствам, одобренным для лечения остеопороза. Ризедронат (Actonel®), терипаратид (Forteo®) и алендронат (Fosamax) — все это таблетированные формы бисфосфонатов, а кальцитонин (Miacalcin) представляет собой истинный стимулирующий остеосинтез гормон, который можно вводить как путем инъекций, так и интраназально.
Стандартизованные показатели плотности костной ткани разработаны для здоровых женщин одного и того же возраста. Остеопения определена как уменьшение плотности костной ткани более чем на одно стандартное отклонение от среднего показателя, а при остеопорозе плотность уменьшается более чем на два стандартных отклонения.
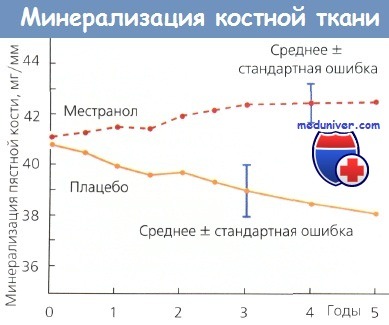
Средняя минерализация пястной кости в течение 5-летнего периода наблюдения за группой пациенток;
начало наблюдения — через 3 года после двусторонней овариэктомии.
Остеопороз — это заболевание, характеризующееся низкой массой костной ткани и нарушением ее архитектоники, которые ведут к повышенной хрупкости костей и увеличению риска переломов. Снижение плотности костной ткани связано с уменьшением ее максимальной массы (в основном, в связи с генетическими особенностями) и разрежением костного вещества, возникающим в постменопаузе и при старении.
Через 5—8 лет после менопаузы линейный процесс разряжения костной ткани ускоряется.
При ремоделировании костной ткани особый интерес представляют две анатомические области. К первой относится осевой скелет, в основном это губчатые кости, ко второй — добавочный скелет, который представлен трубчатыми костями. В обеих группах костей цикл ремодслирования аналогичен. Тем не менее каждый год из-за большей площади поверхности «обновляется» приблизительно 40% губчатой костной ткани, в то время как для трубчатых костей этот показатель составляет всего 10 %. За процесс реабсорбции старой костной ткани, который сопровождается образованием полостей разряжения, ответственны остеокласты. Затем в эти полости направляются остеобласты, где они секретируют остеоид, который по сути представляет собой коллаген 1 типа.
Коллаген подвергается процессу минерализации, в основном ионами кальция, за счет чего приобретает соответствующую механическую прочность. В нормальных условиях потерянная костная ткань замещается таким же количеством новой ткани; однако возможно разобщение этих процессов в случае, если остеокласты удалят больше костной ткани, чем в норме могут восстановить остеобласты, что в итоге ведет к снижению общей костной массы. У женщин в постменопаузе ускоренный процесс разряжения костной ткани сопровождается высоким уровнем ее обновления и увеличением активности остеокластов. Эстрогены способны ингибировать активность остеокластов, при этом одновременно увеличивая пролиферацию остеобластов и синтез коллагена.
Все более изученным становится благоприятный эффект эстрогенов при профилактике и лечении остеопороза в постменопаузе. Общепризнано, что именно остеопороз становится основной проблемой здравоохранения в США. Примерно 8 млн женщин в США страдают остеопорозом и еще 14 млн относятся к категории риска в связи с пониженной костной массой. Ежегодно остеопороз служит причиной более чем 1,5 млн переломов, включая 300 000 переломов шейки бедренной кости, 700 000 переломов позвонков и 200 000 переломов костей запястья. Эти переломы встречаются в основном у женщин.
Читайте также: Какая ткань нужна для тюрбана
Для 50-летней женщины риск в течение жизни одного из трех перечисленных переломов составляет 40 %. Традиционно факторами риска остеопороза считаются дефицит эстрогенов, светлая кожа, употребление большого количества кофеина, недостаточное поступление кальция в организм, астенический тип телосложения, курение, недостаточная физическая активность, а также множество заболеваний и лекарственных средств. Финансовые затраты на лечение остеопороза составляют в США 14 млрд. долларов в год, при этом в 70 % случаев эти затраты обусловлены переломом шейки бедренной кости. Риск этого перелома в возрасте 90 лет составляет 20 %.
Дополнительный риск летального исхода, связанного с переломом шейки бедренной кости, в течение первого года после травмы равняется 12—20 %. К прежнему уровню физической активности после данного вида перелома возвращается менее половины пациентов. Многие утрачивают самостоятельность и требуют длительного ухода на дому. Примерно в 50 % случаев переломы позвоночника бессимптомны. Переломы нескольких позвонков могут приводить к уменьшению роста, кифозу и хронической боли в спине. Приблизительно 10 % больных с переломом шейки бедренной кости умирают из-за хирургических осложнений в течение первых 6 мес. после перелома. Около 25 % всех белых женщин старше 60 лет имеют компрессионные переломы позвоночника вследствие остеопороза. В возрасте 90 лет риск перелома шейки бедренной кости составляет 20 %, при этом у женщин данный перелом встречается в 2,5 раза чаще, чем у мужчин.
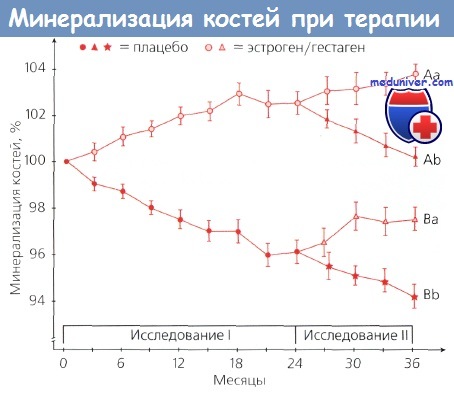
Минерализация костей в зависимости от срока и вида терапии в группах из 94 (исследование I) и 72 (исследование II) женщин вскоре после наступления менопаузы.
Ускорение темпа снижения плотности как трубчатых, так и губчатых костей связано с постменопаузой. На основании данных 5 —10 лет наблюдения за 82 женщинами в постменопаузе Meema и соавт. пришли к следующим выводам:
1) у всех женщин в постмснопаузе происходит снижение плотности костной ткани, при этом начало данного процесса имеет более выраженную взаимосвязь с темпом утраты функции яичников, а не с возрастом женщины;
2) темпы разряжения костной ткани значимо не коррелировали с возрастом пациенток;
3) назначение эстрогенов (например, 0,625 мг КЛЭ) оказывало профилактический эффект в отношении снижения плотности костной ткани.
Аналогичный благоприятный эффект при назначении эстрогенов был продемонстрирован Lindsay и соавт. в кратковременном двойном слепом исследовании изменений плотности пястных костей у женщин с удаленными яичниками, получавших в среднем по 25 мкг местранола в сутки.
Nachtigall и соавт. провели 10-летнее двойное слепое проспективное исследование, целью которого было изучить эффективность ЗГТ. Выборка исследования включала 84 пары случайно отобранных женщин в постменопаузе, при этом пары были сформированы с учетом возраста и диагноза. Одна половина пациенток получала КЛЭ и в циклическом режиме прогестерон, а другая — плацебо. В группе женщин, получавших эстрогены, у которых терапия была начата в течение первых 3 лет после наступления менопаузы, отмечалось уменьшение выраженности или отсутствие прогрессирования остеопороза. У пациенток контрольной группы наблюдалось нарастание остеопороза.
Представленный анализ результатов исследования свидетельствовал об отсутствии в этих двух группах статистически значимого различия в отношении тромбофлебита, инфаркта миокарда или злокачественных опухолей матки.
Более того, в группе заместительной гормональной терапии (ЗГТ) заболеваемость раком молочной железы (РМЖ) была ниже. Получавшие эстрогены пациентки характеризовались большей склонностью к желчнокаменной болезни. Данное исследование, несмотря на небольшое число участниц, исключает спекуляции о высокой частоте осложнений при терапии эстрогенами.
В другом перекрестном исследовании отмечено, что после 3 лет эстроген-прогестиновой терапии содержание минеральных компонентов кости возросло, а в группе плацебо — продолжало снижаться. Когда некоторым женщинам из группы эстроген-прогестиновой терапии назначали плацебо, отмечалось снижение плотности костной ткани, в то время как при назначении гормональной терапии женщинам, получавшим плацебо, наблюдалось увеличение минерализации костей. К другим важным факторам профилактики остеопороза относятся адекватное содержание кальция в пище, дозированные физические нагрузки и прием витамина D. Результаты многих исследований типа «случай-контроль» свидетельствуют о выраженной профилактической эффективности ЗГТ в отношении переломов шейки бедренной кости.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Свежие записи
- Балкон в многоквартирном доме: является ли он общедомовым имуществом?
- Штраф за остекление балкона в 2022: что это и как избежать наказания
- Штраф за мусор с балкона: сколько заплатить за выбрасывание окурков
- Оформление балконного окна: выбираем шторы из органзы
- Как выбрать идеальные шторы для маленькой кухни с балконом
